Maladie d'Alzheimer
Date de dernière édition : 5/11/2022
La maladie d'Alzheimer est une maladie neurodégénérative incurable caractérisée, cliniquement, par une démence avec une atteinte mnésique précoce et, histologiquement, par la présence de dépôts de protéines béta-amyloïdes et tau. Hors de rares formes génétiques, son étiologie est inconnue.
Elle représente la première cause de démence (≈ 33% des démences des 65 à 75 ans, 95% des démences des > 85 ans) avec une prévalence ≈ 3% (5% des > 65 ans) et un sex ratio de 1,5 femmes pour 1 homme (à relativiser de par l'espérance de vie masculine plus courte). On définit les formes "à début précoce" en cas de survenue à < 65 ans. ≈ 10% des malades présentent cependant une démence "mixte" (co-existence avec une autre cause de démence, généralement vasculaire).
De par sa prévalence et son coût psycho-social, elle représente un enjeu majeur de santé publique.
Eléments d'anatomopathologie et étiopathogénie
Maladie neurodégénérative avec atrophie corticale progressive et irréversible (généralisée au stade de démence mais ++ pariéto-temporale et hippocampique) avec dilatation des sillons corticaux et des ventricules (hydrocéphalie ex-vacuo) à l'imagerie et présence d'anomalies microscopiques typiques :
- plaques séniles amyloïdes = dépôts extracellulaires protéiques (++ béta-amyloïde < APP)
- angiopathie amyloïde < béta-amyloïde dans les parois vasculaires
- dégénérescence neurofibrillaire expansive < enchevêtrement intracellulaires de filaments de protéine tau
- dégénérescence granulo-vacuolaire des neurones pyramidaux du cortex enthorinal
Atteinte de tous les systèmes de neurotransmetteurs mais prédominance de l'atteinte cholinergique. Hypothèses quant à la mort neuronale : gain de fonction toxique de la béta-amyloïde et/ ou perte de fonction de l'APP.
L'étiopathogénie est inconnue, supposée multifactorielle sur base de la mise en évidence de :
- Facteurs de risque génétiques prédisposants (ex: allèle E4 de l'apolipoprotéine E)
- Facteurs de risque acquis (hypercholestérolémie, sédentarité, suralimentation, hypertension artérielle mal contrôlée,…)
Il existe cependant des formes rares (< 5% des cas) héréditaires monogéniques à début présénile (< 65 ans) dues à des mutations de l'APP ou des présénilines (partie du complexe protéolytique) 1 ou 2 (augmente la forme AB42).
Clinique et diagnostic
Le diagnostic est avant tout clinique et reste un diagnostic d'exclusion ! Le diagnostic de certitude est autopsique. Parfois difficile du fait de la coexistence fréquente avec d'autres causes de (pseudo)-démences (++ vasculaire et anxio-dépression).
Il existe des critères cliniques fixés par le DSM IV :

Elle se caractérise par une démence d'évolution lente (quelques années), débutant souvent par des troubles mnésiques (++ antérograde, épisodique récente. Mémoire ancienne préservée. Non amélioré par l'indiçage [caractéristique commune aux troubles corticaux]). Plus tardivement : troubles de l'orientation spatio-temporelle, langage pauvre et simplifié, calcul difficile, apraxies (difficultés à l'habillage/ la conduite), agnosies (non reconnaissance des proches), altération de la logique/ du raisonnement/du jugement, idées délirantes (jalousie absurde envers une compagne âgée,…), troubles émotionnels/ de l'humeur (dépression), troubles du comportement, troubles du rythme veille-sommeil.
Les déficits neurologiques focaux sont rares. Les troubles de la marche (++ praxiques), de la continence ou visuels ou des crises épileptiques (15%) caractérisent des stades très avancés. Une rigidité extrapyramidale ou des myoclonies (< 10%) sont de mauvais pronostic (évolution rapide). De règle, la présence précoce de ces "signes positifs" impose la recherche d'un autre diagnostic.
La progression est lente et aboutit à la phase terminale après une moyenne de 7-10 ans : grabataire, non communiquant et totalement dépendant → décès (++ par affections intercurrentes). En moyenne, perte de 3 points au MMS / an. Un MMS stable plusieurs années consécutives doit faire revoir le diagnostic.
Diagnostic différentiel
Le diagnostic différentiel de la maladie d'alzheimer est celui des syndromes démentiels. Une attention particulière doit être portée aux causes de démences et "pseudo-démences" potentiellement (partiellement) réversibles (dépression et troubles psychiatriques, carence en vitamine B12, neurosyphilis, hypothyroïdie,...) ou dont l'évolution peut être stoppée ou ralentie (démences vasculaires, pathologies inflammatoires du système nerveux central,...).
Examens complémentaires
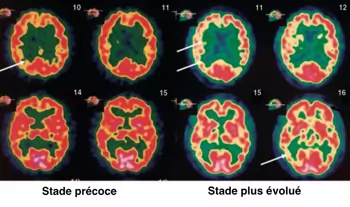 Maladie d'Alzheimer - PET-scan au FDG - développement d'un hypométabolisme diffus plus marqué en temporal |
Le diagnostic positif étant exclusivement clinique, les examens complémentaires (hors testing neuropsychologique) ne se justifient en routine clinique que pour exclure des causes curables de syndromes démentiels.
- CT-scanner / RMN cérébrale → atrophie parahippocampiques aux stades précoces (rarement vue au CT) puis atrophie corticale diffuse ou à prédominance rétro-rolandique. L'IRM peut permettre de quantifier l'atrophie hippocampique (mais sa spécificité est discutée).
- Imagerie fonctionnelle → diminution de la perfusion et du métabolisme diffuse (précoce en temporal, prédominance frontale dans les stades tardifs)
- Ponction lombaire → augmentation de la protéine tau et diminution de la protéine béta-amyloïde Aβ 1-42 (sensibilité et spécificité ≈ 85% → plus médiocres que les tests cliniques !). Ces dosages ne sont pas recommandés en pratique clinique.
- Génétique → gènes APP, PS1 et PS2 (formes autosomiques dominantes très rares), ApoE.
- Electro-encéphalogramme → lent diffus +++, diverses anomalies aspécifiques possibles
Prise en charge thérapeutique - Traitements
Plus précoce est la prise en charge (++ symptomatique et para-médicale, minimiser au maximum les médications), plus la dégradation de l'autonomie du patient sera ralentie.
- Ralentir l'évolution des troubles cognitifs – améliorer les troubles comportementaux
- EBM faible. Pas d'EBM démontrant un impact clinique. Néanmoins recommandés sous certaines conditions et sous réserve d'une bonne tolérance. A discuter donc selon les préférences du médecin et du patient.
- Inhibiteurs de la cholinestérase si MMS > 10 (baisse du déficit cholinergique) (donepezil = aricept 5-10 mg/ jour, rivastigmine = exelon, galantamine = reminyl) (CI = insuffisance hépatique, arythmies). Rares mais graves ES. On peut les arrêter en 2-4 semaines lorsque le MMS passe < 10 (à réinstaurer si dégradation comportementale).
- Mémantine = ebixa 5 vers 20 mg si MMS <17 (baisse du "bruit de fond parasite", inhibiteur des récepteurs glutamatergiques). Rares mais graves effets secondaires. Seul ou en combinaison aux anti-cholinestérasiques.
- Symptomatique
- Troubles comportementaux :
- attitude minimaliste et éviter les combinaisons !
- éviter les antidépresseurs à effet anticholinergique (++ tricycliques → préférer un SSRI à l'exception de la paroxétine)
- réserver les anxiolytiques (effet secondaire fréquent : dégradation cognitive) et les neuroleptiques (effet secondaire : syndrome extrapyramidal des neuroleptique → préférer les atypiques tel que le zyprexa) aux troubles sévères
- Traiter les pathologies chroniques susceptibles d'aggraver la démence, en particulier les facteurs de risque cardio-vasculaire, le diabète, les dysthyroïdies, les troubles dépressifs et psychotiques, la déshydratation, les infections, les carences vitaminiques,...
- Attitude mesurée pour les pathologies lourdes (néoplasies, réanimation,…) en fonction du degré résiduel d'autonomie
- Troubles comportementaux :
- Neuroprotection (statines, vitamine E, anti-oxydants,…) : aucune efficacité démontrée…
- Prise en charge paramédicale
- C'est en fait le plus important... et souvent le plus négligé.
- Orienter précocément le patient et ses proches vers une assistante sociale spécialisée
- Centre de jour, logopèdes, kinésithérapie, stimulation cognitive, occupationnel,… Non démontré efficace mais contribue au bien-être du patient et de ses proches… mais coût social énorme...
- Tenter de maintenir autant que possible le patient dans le cadre familial (maintien des repères) et procéder à un glissement progressif vers des centres de placement (permettant une adaptation du patient et minimisant la culpabilité pour la famille). Idéalement, chaque étape suivante doit être anticipée en parallèle à la dégradation de l'autonomie du patient : il ne faut pas attendre la survenue d'incidents graves au domicile ou l'épuisement des proches pour évoquer la mise en place d'aides au domicile puis un placement. Trop souvent les patients sont placés "en urgence" via un séjour hospitalier alors que cela devrait être l'exception.
- Assurer la protection médico-légale des patients (escroqueries, maltraitance) et des proches (épuisement, culpabilité)
Auteur(s)
Dr Shanan Khairi, MD