Relations hôtes-pathogènes
L’espèce humaine évolue au sein d’un écosystème complexe d’agents commensaux, opportunistes et pathogènes dont la liste n’est certainement pas close. L’équilibre subtil entre les différents partenaires n’est pas encore finement élucidé comme en témoigne les découvertes récentes par exemple sur le microbiote intestinal et son rôle complexe dans plusieurs maladies.
Généralités
On distingue la flore commensale saprophyte et la flore pathogène.
La flore commensale joue un rôle important (et encore mal connu) et contribue par exemple à la production de vitamines, la digestion de la cellulose,... La composition de la flore commensale est relativement stable, et il est difficile pour une bactérie étrangère de s’y installer. On peut même observer des mécanismes d’exclusion: un staphylocoque doré empêchant par exemple l’implantation d’un autre staphylocoque doré au même endroit. A noter que cette flore saprophyte contamine potentiellement de nombreux prélèvements microbiologiques (expectorations, culture d’urines, hémoculture,...), et qu’il s’agira toujours pour le clinicien d’interpréter avec pertinence les résultats d’examens microbiologiques quand les prélèvements proviennent de sites naturellement colonisés.
Certains organismes commensaux sont capables de causer une infection chez un hôte fragilisé ou immunocompromis, et se comportent alors comme des pathogènes opportunistes (c’est le cas de S aureus, de Candida, mais aussi de Staphylococcus epidermidis face à un corps étranger tel un cathéter).
Les agents anti-infectieux perturbent cette flore commensale, au même titre que certains agents de chimiothérapie ou certaines pathologies. Ainsi, une cure d’amoxicilline-clavulanate peut causer des modifications majeures de la flore vaginale et induire une mycose à Candida.
Les agents probiotiques (micro-organismes vivants) peuvent restaurer en théorie une flore altérée par une antibiothérapie, mais l’expérience clinique est encore très limitée. De la même façon, la restauration d’une flore fécale utile au contrôle d’une infection à Clostridium difficile peut être obtenue par transplantation fécale, technique en pleine exploration actuellement.
Une flore exogène peut coloniser et infecter un individu, que cette flore exogène soit de source humaine (transmission d’une souche de staphylocoque doré d’un individu à l’autre), ou pas. C’est dans cette dernière catégorie que l’on trouve les agents pathogènes qui vont atteindre un individu par contact cutané, ingestion, inhalation, contact muqueux, ….
La flore pathogène, elle, par définition, n’est pas trouvée en dehors d’un état pathologique chez un individu (ex Brucella, Yersinia, ….). En cas d’exposition d’un individu à cette flore, elle entrera en compétition avec la flore saprophyte au niveau de la peau ou des muqueuses. Celle-ci finira souvent par éliminer la flore intruse. A noter cependant qu’exceptionnellement certains individus peuvent être porteurs chroniques de microorganismes pathogènes (ex portage fécal de Salmonella).
Représentations schématiques des sites d'infections bactériennes et virales
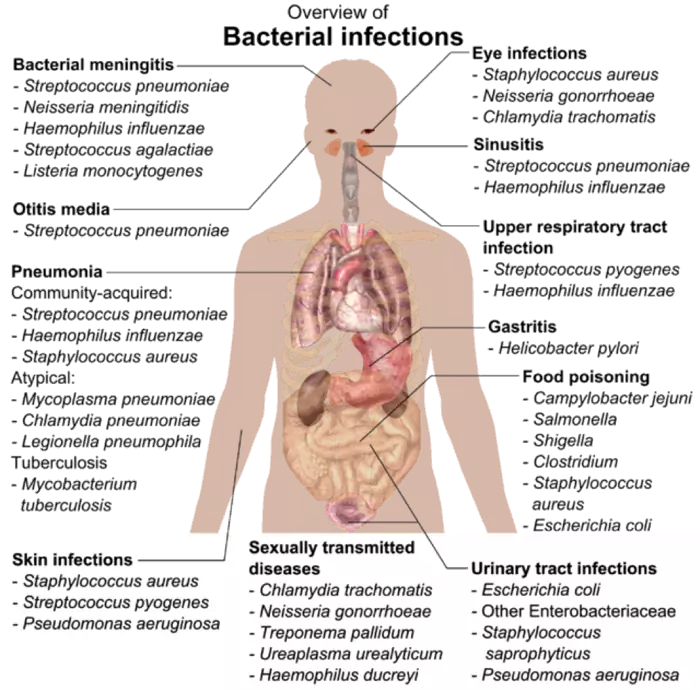
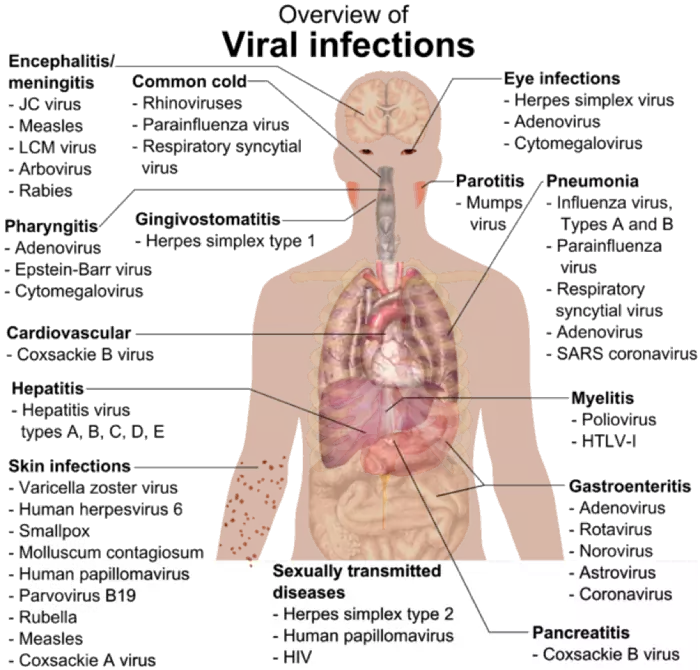
Il faut souligner l’importance du lien entre des organismes commensaux et pathogènes donnés et leurs organes cibles. Ceci permet de faire le lien entre un tableau clinique déterminé et un traitement anti-infectieux empirique (plus particulièrement le "pari bactériologique raisonné") approprié.
On observe le même mécanisme avec les microorganismes résistants : la résistance a un coût énergétique (production de beta-lactamases par exemple) qui n’est favorable qu’en présence d’antibiotiques. Un individu sain exposé à des microorganismes résistants (lors d’un voyage en Inde par exemple) sera souvent colonisé, mais au bout de quelques mois et en l’absence d’antibiotiques, il aura éliminé l’intrus.
La flore microbienne tapisse l’ensemble du revêtement cutané et des muqueuses. La pression antibiotique va en modifier considérablement le spectre et induire rapidement des effets délétères tels que diarrhée ou vaginite par exemple. Les effractions mécaniques (chirurgie, plaie, cathéters, sonde), les altérations médicamenteuses (chimiothérapie, etc…) vont favoriser la colonisation de sites stériles et la pénétration des bactéries dans le corps.
Les facteurs de virulence de l’agent infectieux, l’inoculum présent combinés aux paramètres propres au patient détermineront la capacité à induire ou pas une infection.
Le processus infectieux
On peut distinguer trois étapes fonctionnelles : adhésion du micro-organisme à la cellule cible (avec éventuellement pénétration dans celle-ci), développement de l’infection et dissémination de l’agent infectieux , et ensuite dispersion de l’agent et contamination d’un nouvel hôte.
Attachement
Très peu de pathogènes sont capables de directement pénétrer le corps au travers de la peau, c’est le cas par exemple des cercaires de schistosomes. Pour la plupart d’entre eux, une étape préalable est nécessaire : l’attachement à la surface cellulaire. De très nombreux mécanismes sont impliqués dans cette étape cruciale de l’adhérence. Celle-ci requiert la présence d’adhésines à la surface du microbe d’une part, et de récepteurs de cellules hôtes d’autre part. Ceci explique très largement la spécificité d’adhérence entre un type d’agents infectieux et un type de cible cellulaire, (pneumocoque et épithélium respiratoire par exemple, ou affinité variable des virus influenza vis-à-vis de différents épithélia en fonction de la combinaison HxNx). La matrice extracellulaire qui recouvre les cellules muqueuses est riche de nombreux polysaccharides et protéines qui sont autant de récepteurs pour les adhésines bactériennes et les récepteurs viraux.
Invasion
Les organismes invasifs le sont par leur capacité à rompre les ponts intercellulaires des muqueuses ou à envahir les cellules directement par différents mécanismes apparentés à la phagocytose (comme la transcytose du méningocoque). Ex : shigellose, brucellose, méningococcémie, listériose….
Cependant, de nombreux pathogènes n’ont pas besoin de passer par une forme invasive pour déclencher une infection et provoquent la maladie sans pénétrer dans l’épithélium (ex : coqueluche, diphtérie, giardase, trichomonase, entérite due à E coli entéropathogènes).
Diffusion
Parmi les micro-organismes capables d’effracter les barrières mécaniques ou de s’engouffrer dans une rupture de celle-ci (plaie) et qui échappent aux mécanismes de défense de l’espace sous épithélial (dont le principale est la phagocytose), certains pourront déclencher une invasion tissulaire profonde, parfois en utilisant d’ailleurs le transport par des cellules APC (cellules dendritiques par exemple) ou en effractant directement les vaisseaux sanguins (méningocoque), ou par inoculation dans ceux-ci (plasmodium) ou encore à l’occasion d’une rupture de ceux-ci (streptocoques). Dans le torrent sanguin, en circulation libre ou à l’intérieur d’une cellule transporteuse (HIV et lymphocyte, ou Ebola et cellules dendritiques par exemple). Des éléments importants de l’immunité naturelle vont contribuer à éliminer les agents infectieux au niveau de compartiment sanguin et contribuent au pouvoir bactéricide naturel de celui-ci, c’est le cas notamment du complément.
Dommages liés à l’infection
Les infections sont souvent caractérisées par des dommages cellulaires et tissulaires causés directement ou indirectement par l’agent causal. Chacun d’entre eux induit donc des lésions en fonction de sa nature et des mécanismes plus ou moins spécifiques dont il dispose.
Dommages causés directement ou indirectement par les agents infectieux :
|
|
Mécanisme |
Exemples |
|
Dommages directs |
Toxines |
LPS, .. |
|
|
Enzymes |
coagulase de S aureus, hyaluronidase de streptocoque |
|
|
Apoptose |
HIV sur CD4+ |
|
|
Effet cytopathique |
RSV, CMV, |
|
|
Malignisation |
papillomavirus, |
|
Dommages via réponse immunitaire |
Auto-immunité |
rhumatisme articulaire |
|
|
Réaction d’hypersensibilité immédiate |
rashs infections helminthiques |
|
|
Complexes immuns |
glomérulonéphrite de l’endocardite |
|
|
Hypersensibilité retardée |
granulome tuberculeux, nécrose caséeuse |
Exemples de toxines :
|
|
Source |
Cible |
Action |
|
Endotoxines (lipopolysaccharides - LPS) |
Bacilles Gram Négatifs (BGN) |
macrophages, neutros, lymphos B, endothelia,… |
Fièvre, réaction inflammatoire, shock |
|
Superantigènes |
S aureus, streptocoque pyogène |
Lympho, macrophages |
Toxic shock syndrome, choc, .. |
|
Toxine cholérique |
Vibrio cholerae |
entérocytes |
Diarrhée cholérique |
Dommages de la réponse inflammatoire et/ou immunitaire
Plusieurs mécanismes physiologiques activés en réponse à l’infection induisent eux-mêmes des dommages en cas de réponse excessive :
- Lymphocytes cytotoxiques (CTL) : ceux-ci sont capables de détruire les cellules infectées et sont donc impliqués dans de nombreux phénomènes physiopathologiques associés aux infections virales.
- Auto-immunité : le rhumatisme articulaire aigue est induit par la production, en réponse à une infection par des streptocoques du groupe A (pharyngite), d’anticorps réagissant avec des composants de l’endocarde, et de la membrane synoviale.
- Les superantigènes : les superantigènes sont des molécules capables d’activer une réponse immune polyclonale : ils sont capables de se lier aux TCR de (très) nombreux lymphocytes T qu’ils vont activer. Il en résulte une libération excessive de cytokines, qui produisent alors un tableau de toxic shock (ex S aureus porteur de TSST) (toxic shock syndrome toxin).
- La libération de nombreux médiateurs de l’inflammation va induire les effets cliniques généraux (fièvre, vasoconstriction, …) qui peuvent conduire à des tableaux très sévères de choc et défaillance multisystémique (le choc septique).
L’échappement aux systèmes de défense
Une longue série de mécanismes sont connus qui visent à permettre à l’agent infectieux d’échapper à la destruction. Quelques exemples :
- éviter la phagocytose (capsule de pneumocoque, méningocoque)
- lyse du phagocyte (toxine PVL de S aureus)
- survivre dans le phagocyte (inhibition du phagosome par le BK ; Listeria, Salmonella, …)
- destruction des lymphocytes (HIV)
- variation antigénique (Influenza, gonocoque, HIV, …)
- refuge dans des sanctuaires : infection latente à HSV dans les ganglions dorsaux, …
Ces différents mécanismes participent aux caractéristiques physiopathologiques des différents agents infectieux et contribuent à comprendre ceux-ci et les conséquences cliniques qui en découlent.
Les états d’immunosuppression
De très nombreuses entités pathologiques s’accompagnent d’altération du système immunitaire. Celles-ci induisent une ou plusieurs failles dans le contrôle de l’invasion par des microorganismes infectieux, et la nature du déficit permet de déduire le risque infectieux qui en découle.
Certains de ces déficits sont congénitaux, d’autres sont liés à une immaturité du système immunitaire (période périnatale), à la sénescence, induits par un état physiologique transitoire (l’immunodépression de la grossesse), une maladie (l’urémie), une infection (l’infection par le VIH), un traitement immunosuppresseur (les anti-TNF, les immunosuppresseurs utilisés en transplantation d’organe), ou les chimiothérapies.
Immunodéficiences primaires
Ces déficits immunitaires sont nombreux, relativement fréquents (1/500 naissances environ), de nature très diverses et donc d’expression clinique très variable. Certaines de ces pathologies entrainent une très forte sensibilité aux infections et se révèlent fatales parfois à très courte échéance, tandis que d’autres, qui entrainent des infections plus rares et/ou moins sévères ne seront découvertes que beaucoup plus tard. (voir cours d’immunopathologie).
Infections caractéristiques de quelques immunodéficiences primaires :
Micro-organismes |
Site anatomique affecté |
Contexte d'immunodéficience |
|
Bactéries intracellulaires, virus, protozoaires, champignons |
Non spécifique |
SCID, DiGeorge |
|
Pneumocoques, streptocoques, Haemophilus |
Poumons, peau, SNC |
Déficiences en IgG, IgM |
|
Bactéries entériques et virus |
Tractus digestif, nez, yeux |
Déficiences en IgA |
|
Staphylocoques, klebsielles, Pseudomonas, |
Poumons, peau, ganglion lymphatique drainant |
Maladie granulomateuse chronique (CGD) |
|
Aspergillus |
Poumon, disséminée |
CGD |
Immunodéficiences acquises
Hormis la cause infectieuse de loin la plus fréquente (l’infection par le VIH, voir ci-dessous), les causes les plus fréquentes d’immunodéficiences acquises sont les traitements anticancéreux (chimiothérapie, radiothérapie) et les traitements immunosuppresseurs utilisés en transplantation d’organe et dans le traitement de maladies auto-immunes et inflammatoires. Deux grands tableaux cliniques prédominent : la neutropénie fébrile, en général de courte durée, induite par la chimiothérapie des tumeurs solides et des leucémies aigues (c’est dans cette dernière situation qu’elle est la plus profonde et de la plus longue durée) et l’immunodépression par atteinte des lymphocytes (corticostéroïdes, anticorps monoclonaux ciblés sur lymphos T et / ou B, agents immunosuppresseurs utilisés en transplantation). Les conséquences en sont reprises sous forme simplifiée ci-dessous.
Principaux agents opportunistes rencontrés dans les états d’immunodépression :
Type d'immunodépression |
Agents opportunistes |
|
Neutropénie (et déficit fonctionnel des polynucléaires) :
|
cocci à Gram positif bacilles à Gram négatif mycoses |
|
Déficit de l'immunité humorale :
|
pneumocoque Haemophilus bacilles à Gram négatif |
|
Déficit de l'immunité cellulaire :
|
Listeria, Salmonella, Legionella, Nocardia mycobactéries mycoses Pneumocystis et toxoplasme CMV, herpes simplex et zoster, adenovirus,… |
En toute logique, le déficit de l’immunité cellulaire favorise toute une série d’agents caractérisés par leur capacité à pénétrer dans les cellules ; qu’ils soient viraux, bactériens ou mycobactéries.
Une fois que l’immunodéficience est détectée et que sa nature est connue, et, a fortiori, dès qu’une attitude thérapeutique entraine une immunodéficience iatrogène, il revient au clinicien à proposer au patient toutes les possibilités prophylactiques utiles (ex administration de cotrimoxazole en prophylaxie de l’infection à Pneumocystis) et à être particulièrement attentif aux signes cliniques évocateur d’un infection, voire à monitorer des paramètres utiles (surveillance radiologique, biologique, …).
Auteur(s)
Pr Baudouin Byl, MD, PhD
(Reformatage par Dr Shanan Khairi, MD)