Sclérose en plaques (SEP)
Date de dernière édition : 22/09/2024
La sclérose en plaques (SEP) est une pathologie inflammatoire chronique caractérisée par l'existence de lésions démyélinisantes et axonales multiples disséminées dans le système nerveux central.
L'étiologie de la SEP est inconnue. Elle est plus fréquente dans les pays tempérés et froids avec un gradient de prévalence décroissant nord-sud, chez les blancs, chez les 15 à 40 ans (médiane de survenue à 23 ans, moyenne à 30 ans, les formes progressives primaires étant plus tardives) et chez les femmes (sex ratio de ~ 2 femmes pour 1 homme). Sa prévalence globale en Europe et aux Etats-Unis est de ~ 50 cas/ 100.000 habitants.
Etiopathogénie
L'étiologie est inconnue, mais on constate que:
- les migrants de première génération conservent la prévalence de SEP de leur pays d'origine alors que les migrants de deuxième génération acquièrent la prévalence de SEP du pays d'accueil.
- il existe des formes familiales (15% des cas). En outre, un jumeau monozygote d'un patient atteint de SEP a 25% de risque de développer une SEP contre 4% pour des frères non jumeaux.
→ on suppose l'intrication de facteurs auto-immuns génétiques et environnementaux (infection virale ? Rôle immuno-modulateur de la vitamine D ?), ces derniers semblant déterminants.
L'atteinte se caractérise par une atteinte initialement inflammatoire du système nerveux central, démyélinisante, une perte axonale et une atrophie cérébrale plus tardive.
Clinique, évolution, pronostic
La clinique est polymorphe et caractérisée par une fluctuation des atteintes dans le temps et l'espace. L'installation de la sclérose en plaques est généralement (~ 47-70% des cas) monosymptomatique, le premier signe étant une atteinte motrice dans 40% des cas, une névrite optique dans 30% des cas, des troubles sensitifs dans 20% des cas, et plus rarement une atteinte des autres nerfs crâniens, cérébelleuse, sphinctérienne ou sexuelle.
C'est fréquemment la répétition d'épisodes déficitaires spontanément régressifs qui fera évoquer le diagnostic. Certains tableaux clinique sont cependant d'emblée très évocateurs.
Tableaux cliniques initiaux évocateurs
- Névrite optique rétrobulbaire (NORB) :
- Très évocatrice (premier signe d'une SEP dans 30% des cas et, surtout, plus de 50% des jeunes présentant une névrite optique développeront une SEP).
- Installation (unilatérale ++) sur quelques heures ou jours (rechercher d'autres diagnostics en priorité si l'installation se fait sur plus de deux semaines) d'une baisse d'acuité visuelle (++ scotome [para]-central) avec une douleur périorbitaire d'apparition précoce exacerbée par les mouvements oculaires (++ vers le haut). La récupération se fait sur ~ deux mois en moyenne. Les déficits visuels persistant à six mois sont généralement définitifs (5% des patients conserveront une acuité visuelle < 4/ 10).
- Nystagmus pendulaire : très évocateur, rarement initial
- Myélite aiguë → paraparésie aiguë s'installant en quelques heures ou jours avec des troubles sensitifs suivant un niveau métamérique. En cas de myélite transverse l'installation est plus rapide et plus sévère.
- Troubles sensitifs : paresthésies des membres inférieurs, signe de Lhermitte (décharge électrique dans les 4 membres à la flexion du cou signant une lésion des cordons médullaires cervicaux postérieurs), névralgie du trijumeau (évocateur si elle survient à < 50 ans),…
- Atteinte du tronc cerébral → ++ diplopie (atteinte du nerf VI >> III >> IV), ophtalmoplégie internucléaire (classique en cours d'évolution mais rarement révélatrice), vertiges, névralgie du trijumeau,…
- Atteinte cérébelleuse (rarement révélatrice) : dysmétrie, dysarthrie, ataxie, tremblements intentionnels,…
- Atteinte hémisphérique (rarement révélatrice) → tableaux "pseudo-vasculaires" : hémiparésie/ (aphasie) d'installation rapide
- Troubles sphinctériens (mictions impérieuses) ou sexuels d'installation (sub)-aiguë chez un jeune
Clinique en cours d'évolution
- Signes moteurs déficitaires et atteinte pyramidale : 80% des patients présenteront un syndrome pyramidal. Lors des phases progressives, la constitution d'une paraparésie insidieuse est fréquente, pouvant même être précédée d'une véritable claudication intermittente médullaire
- Troubles cérébelleux : fréquents en cours d'évolution, parfois prédominants. Troubles de la coordination, tremblement cérébelleux (++ d'intention, rarement associé à un tremblement d'attitude/ de repos), ataxie sévère, dysarthrie cérébelleuse (voix scandée, explosive)
- Atteintes du tronc cérébral : seront notées chez ~75% des patients
- Troubles oculomoteurs (VI >> III >>> IV) : la diplopie est fréquente durant les poussées, parfois paroxystique se répétant de façon intermittente, flou visuel binoculaire, oscilloscopie, flutter oculaire, opsoclonous, opthalmoplégie internucléaire antérieure (parfois bilatérale !), (troubles du regard vertical, paralysie horizontalee, sd un et demi de Fischer, skew deviation),…
- Nystagmus : très fréquent, de signification svt mal comprise,… ++ pendullaire uni ou bilatéral, rarement horizontaux, verticaux ou positionnels
- Atteinte vestibulaire : ++ instabilité, exceptionnellement vertiges vrai ou surdité
- Divers : névralgie du V, paralysie faciale de type périphérique (inaugurale dans ~ 4,8%, survenant dans 10% en cours d'évolution), dysarthrie (cérébelleuse, paralytique, mixte, spastique), exceptionnellement des troubles de la déglutition, troubles olfactifs (seraient fréquents mais font rarement l'objet de plaintes)
- Troubles sensitifs :
- variés et fréquents, parfois purement subjectifs. Cependant, ils sont plus souvent présents aux membres inférieurs (++ pallesthésie).
- Le signe de Lhermitte (décharge à la flexion du cou) est peu spécifique (peut résulter de toute lésion cervicale postérieure) mais très fréquent
- Douleurs fréquentes (50% neuropathiques, 50% par contractures/ dorsalgies)
- Troubles visuels :
- NORB +++ fréquente, parfois répétée, parfois infraclinique
- Une NORB + myélite + IRM cérébrale (infra)-normale → doit faire évoquer une neuromyélite optique (NMO)
- Uvéite, rare (~1%), parfois infraclinique
- Troubles sphinctériens et génitaux
- Miction impérieuse (85%) +- incontinence, pollakiurie (82%), incontinence urinaire (63%), dysurie (49%), énurésie (14%),…
- → risque majoré d'infections urinaires répétées et de complications graves (hydronéphrose et pyélonéphrites répétées, 19%)
- Incontinence fécale (~29%), constipation (51%)
- Troubles de l'érection, diminution de la libido, diminution des sécrétions vaginales, insensibilité locale, anorgasmie
- Troubles psychiatriques et neuropsychologiques
- Troubles thymiques et psychiatriques : dépression (25-55%), troubles bipolaires plus fréquents (parfois inauguraux) que dans la population générale,…
- Troubles cognitifs (40-70%) variés, réalisant un tableau démentiel chez ~10% des patients (généralement très tardivement dans l'évolution) !
- Aphasie/ alexie : exceptionnel
- Divers :
- Phénomènes paroxystiques divers (diagnostic différentiel : crises épileptiques partielles) : névralgie du V, diplopie, signe de Lhermitte, crises dystoniques (++ spasmes focaux), dysarthrie, ataxie, paresthésies, douleurs, prurit, incontinence urinaire, akinésie, sensations de chaleur,…
- Crises épileptiques (1 à 8% versus 0,5 à 1% dans la population générale) – généralement répondent bien aux anti-épileptiques ou ne nécessitent pas de traitement (la plupart des crises sont bénignes et de survenue limitée dans le temps)
- Troubles dysautonomiques : hypotension artérielle orthostatique, sueurs, fibrillation auriculaire paroxystique,…
- Aggravation ou apparition de troubles variés (++ amblyopie) à l'effort ou à l'élévation de la température corporelle… quelques décès ont même été décrits chez des patients après une exposition au soleil (bloc de conduction favorisé par la chaleur ? Il n'est cependant pas démontré que ces décès soient liés à la SEP proprement dite)
- Fatigue ou asthénie (75-95%) aiguë ou chronique. Pathogénie peu claire (de plus la fatigue est une plainte fréquente chez les patients atteints de tous types de pathologies chroniques) < troubles de la conduction ?? déconditionnement à l'effort ?? troubles du sommeil ?? cytokines inflammatoires ?? psychogène ??
Ont également été rapportés : hypo ou aréflexie (atteinte des cordons postérieurs ?), hémiballisme (atteinte du noyau sous-thalamique).
Au fil du temps les différents types d'atteintes coexistent aboutissant à des handicaps variables dans la vie quotidienne. En outre, les douleurs sont fréquentes et des troubles cognitifs apparaissent dans 50% des cas à 5 ans, voire une démence dans les cas les plus évolués (5%, généralement tardivement). Presque tous les tableaux cliniques sont possibles dans la sclérose en plaques… cependant on ne rencontre quasi jamais de syndrome extrapyramidal ou d'aphasie, et les surdités ou cécités sont exceptionnelles.
Tableaux évolutifs
Formes rémittentes = par poussées-rémissions (~80-90% des présentations initiales)
→ évolution émaillée de poussées (définie comme une apparition/ aggravation rapide de signes neurologiques durant > 48 heures et séparése de la précédente poussée de minimum 1 mois) suivies de rémissions avec ou sans séquelles (rares pour les 1ères poussées).
Les poussées sont à différencier de : manifestations paroxystiques, troubles liés à la chaleur ou un effort inhabituel, épisode infectieux pouvant majorer des anomalies (sub)-cliniques, troubles psychogènes. La fatigue, les troubles sphinctériens, thymiques, du sommeil, cognitifs, les douleurs, les crises épileptiques évoluent généralement indépendamment des poussées.
50% de ces patients passeront à une forme secondairement progressive à 10 ans, 70% à 20 ans et jusqu'à 90-95% au cours de leur vie.
Formes secondairement progressives (concerne 70-80% des patients)
Souvent définie par une progression du handicap à > 6 mois en dehors de toute poussée. Survient en moyenne après 7 ans d'évolution d'une forme rémittente (à ~39 ans). Peut être émaillée de poussées surajoutées tendant à devenir de plus en plus rares.
Le pronostic est très variable (autonomie conservée à 15 ans dans 25% → handicap et décès précoce), la survie médiane post-diagnostic étant de 25 ans. Les facteurs de mauvais pronostic sont:
- un intervalle court entre les deux premières poussées
- un patient âgé
- une forme progressive d'emblée
Formes progressives primaires et progressives à rechutes (concerne 10-20% des patients)
Le tableau est alors généralement celui d'une atteinte médullaire progressive isolée, plus rarement d'un tableau cérébelleux progressif, en début d'évolution. L'âge moyen de début est ~39 ans. L'IRM cérébrale montre généralement moins de lésions focales et prenant moins le contraste que dans les autres formes, mais une atrophie importante est la règle. Possibles poussées surajoutées.
Pronostic
50% des patients atteignent un DSS (mesure d'handicap) 3-4 à ~7,5 ans, un DSS 6 (aide nécessaire pour la marche) à ~15 ans et un DSS 8 (perte totale d'autonomie à la marche) en ~30 ans. Un début précoce ou un long intervalle entre les 2 1ères poussées ou des symptômes initiaux de type NORB ou sensitifs sont corrélés à une évolution plus lente. La survie médiane est ~de 22 ans pour les hommes et de 28 ans pour les femmes (vs 37 et 42 ans chez les témoins).
Pas de corrélation démontrée avec le sexe, les vaccinations, les infections intercurrentes.
Un nombre important de lésions à l'IRM initiale et un accroissement important du volume lésionnel ou le développement d'une atrophie cortico-sous-corticale dans les 5 ans sont des facteurs de mauvais pronostic, indépendamment de la clinique. La présence de lésions à l'IRM médullaire initiale est également un facteur de mauvais pronostic indépendant.
SEP et grossesse
La fréquence des poussées diminue durant la grossesse (++ 3ème trimestre) mais rejoint progressivement en post-partum le taux pré-partum. Le pronostic global ne semble pas influencé. Aucune précaution particulière relative à la maladie n'est à prendre tant pour la grossesse que pour l'allaitement. Tout traitement immuno-modulateur ou immuno-suppresseur doit de règle être arrêté deux mois avant une grossesse.
SEP pédiatrique
1,2-6% des cas débutent à < 16 ans (exceptionnel à < 10 ans, âge le plus précoce décrit = 10 mois). Le sex-ratio prépuberté est de 1/1. Le tableau initial est souvent comparable à celui des adultes mais parfois il peut mimer l'évolution d'une encéphalo-myélite aiguë disséminée (ADEM) ou d'une maladie de Schilder. L'évolution semble plus lente que chez l'adulte.
Examens complémentaires
Ponction lombaire (PL)
→ recherche d'une inflammation dans le liquide céphalo-rachidien (LCR) : pic oligoclonal IG (Se 92-95%) avec bandes très supérieures à celles du sérum + augmentation de l'index IgG (Se 70-88%). Peu spécique (infections, autres pathos auto-immunes, certains syndromes paranéo). Lymphocytes augmentés mais < 50/ mm³, rarement quelques PNN. Un pic monoclonal est moins évocateur et suggère une hémopathie. La protéinorachie est habituellement normale ou discrètement augmentée. Une protéinorachie très augmentée doit faire discuter un autre diagnostic.
→ + cultures, sérologies et PCR selon contexte pour exclure des diagnostics différentiels.
Non indispensable si les critères diagnostics de McDonald sont remplis sur base clinique et IRM ! De nombreux centres spécialisés ne l'utilise plus pour le diagnostic positif et les guide-lines américains ne la reprennent plus dans leurs examens recommandés. Utilité néanmoins pour le diagnostic différentiel.
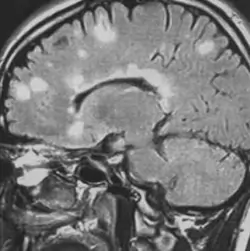
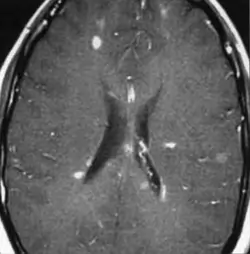
Résonance magnétique (IRM) cérébrale +- médullaire
Les lésions démyélinisantes apparaissent hypersignal en T2/ FLAIR (! lésion aspécifiques, diagnostic différentiel : collagénoses, granulomatoses, lésions vasculaires,…). Les lésions axonales, anciennes ou très œdémateuses apparaissent hyposignal en T1. L'IRM médullaire est nécessaire si : syndrome médullaire ou si l'IRM cérébrale ne montre pas de lésion ou montre des lésions équivoques.
Les lésions de > 6 mm (mais ne dépassant pas 2 étages vertébraux et typiquement latérales lorsqu'elles sont médullaires, sans augmentation du calibre médullaire) périventriculaires, sous-tentorielles, médullaires, du corps calleux sont les plus évocatrices. Les lésions de la jonction cortico-sous-corticale sont fréquentes. Possible atrophie cérébrale ou médullaire dans les formes évoluées. On peut distinguer les lésions anciennes et récentes en IRM T1 + gadolinium (prises de gadolinium = caractère inflammatoire, récent). En cas de corticothérapie (suppression de la prise de gadolinium), l'IRM doit être réalisée minimum 1 mois post traitement.
L'IRM (avec séquences STIR) des nerfs optiques peut aider au diagnostic différentiel entre NORB et névrite ischémique.
Divers selon contexte - diagnostic différentiel et recherche de maladies associées
- Biologie systématique : pour exclure des diagnostics différentiels (CRP-VS, FAN, ANCA, sérologies Lyme, HIV, syphilis, brucellose et autre selon contexte).
- En cas de NORB, recherche de diagnostics différentiels : Examen ophtalmologique + Fonds d'oeil (FO) + enzyme de conversion (ACE) + angiographie rétinienne + PCR virus neurotropes dans LCR + Test de Schirmer
- FO systématique → ! souvent (~66%) normal en début d'évolution d'une NORB ! Possible flou du bord nasal ou hyperhémie de la papille.
- Dyschromatopsie vert-rouge précoce fréquente.
- Recherche génétique d'une maladie de Leber si NORB bilatérale
- Potentiel évoqués visuels et somesthésiques (PEV, PES) en cas de discordance clinico-radiologique (sinon inutiles)
- EMG + dosage B12 + sérologie HTLV 1 < si paraparésie progressive
- Echographie pelvienne + anticorps onconeuronaux + bilan génétique + anticorps antigliadine et anti-endomysium < si ataxie progressive
- Schirmer + biopsie glandes salivaires + angiographie cérébrale + échographie pelvienne + anticorps onconeuronaux < si atteintes multifocales
- Potentiels évoqués + PCR virus neurotropes dans LCR + ACE + anticorps anti-NMO < si myélite isolée
- Biopsie cérébrale < exceptionnellement < bilan non satisfaisant – doute quant à une autre étiologie curable
Diagnostic
Critères de Mac Donald
Nombre de poussées |
Signes de localisation clinique |
Autres critères nécessaires |
> 2 |
> 2 |
Aucun |
> 2 |
1 |
Dissémination IRM dans l'espace (= 3 critères de Barkhof) OU LCR + (bandes oligoclonales OU élévation de l'index IgG) AVEC > 2 lésions suggestives à l'IRM |
1 |
> 2 |
Dissémination IRM dans le temps (= prise de gado sur une IRM réalisée à 3 mois de distance du début de la poussée ou nouvelle lésion en T2 sur une IRM à 3 mois de distance de la précédente) |
1 |
1 |
Dissémination IRM dans l'espace (3 critères de Barkhof) OU LCR + AVEC > 2 lésions suggestives à l'IRM ET Dissémination IRM dans le temps (cf supra) |
0 (progression primaire) |
1 |
LCR + ET Dissémination dans l'espace (> 9 lésions T2 sur l'IRM cérébrale OU 2 lésions sur l'IRM médullaire OU 1 lésion médullaire et 4-8 lésions cérébrales à l'IRM OU PEV + et 4-8 lésions cérébrales à l'IRM OU PEV + et 1 lésion médullaire et moins de 4 lésions cérébrales à l'IRM ET Dissémination IRM dans le temps (cf supra) OU progression clinique sur > 1 an |
Critères (radiologiques de dissémination dans l'espace) de Barkhof
3 critères sur 4 sont nécessaires pour définir une dissémination dans l'espace sur base de l'IRM :
- 1 lésion prenant le gadolinium ou 9 lésions en T2 (les lésions en T2 doivent faire > 3 mm de diamètre, 1 lésion médullaire peut remplacer 1 lésion cérébrale)
- Au moins 1 lésion infratentorielle
- Au moins 1 lésion juxtacorticale
- Au moins 3 lésions périventriculaires
Le problème du diagnostic de SEP devant un épisode clinique isolé
Lorsque le LCR est évocateur et que l'IRM montre plusieurs lésions suggestives, le risque qu'il s'agisse d'une SEP est très élevé même en l'absence de critères permettant d'affirmer une dissémination dans le temps. Le diagnostic différentiel se pose surtout alors avec les névrites optiques idiopathiques, les myélites idiopathiques et les ADEM.
- Les atteintes médullaires sévères avec lésions s'étendant à > 2 segments vertébraux ou les myélites transverses sont peu susceptibles d'évoluer vers une SEP
- Les ADEM sont typiquement post-infectieuses ou post-vaccinales et atteignent souvent des sujets plus jeunes. A l'IRM les ADEM montrent des lésions souvent plus symétriques, prenant le contraste et régressant au moins partiellement après corticothérapie. Il est cependant fréquent qu'un épisode diagnostiqué comme ADEM se révèle par la suite être une SEP
Formes "frontières" ?
Paraplégies progressives
= Démyélinisation médullaire progressive isolée sans aucun autre signe. Forme de SEP progressive ?
Formes pseudo-tumorales, formes à larges plaques, maladie de Marburg, sclérose myélinoclastique de Schilder, sclérose concentrique de Balo
Certains patients présentent des tableaux de début aigu ou rapidement progressif avec des lésions cérébrales disséminées d'allure tumorale. Dans certains cas, l'évolution a été fatale. L'assimilation de ces formes à la SEP est toujours discutée.
Neuromyélite optique
Cf "NMO". Longtemps considérée comme une forme particulière de SEP, il semble qu'il s'agisse d'une entité indépendante, au pronostic nettement plus péjoratif.
Syndrome clinique isolé compatible avec une SEP (CIS)
= survenue isolée d'un épisode neurologique (partiellement) résolutif compatible avec une SEP mais ne remplissant pas les critères diagnostiques de Mac Donald. Sont particulièrement à considérer :
- NORB +++
- Diplopie
- Tableau de myélite
- Troubles cérébelleux
L'évolution vers une SEP à 20 ans est évaluée à ≈ 60% en cas de lésions IRM et de ≈ 20% en cas d'IRM normale (sauf dans les NORB où le risque est plus élevé).
Attitude face à un CIS :
- Eliminer les diagnostics différentiels
- Evaluation : IRM avec T2 et T1 (injection de gadolinium si lésions visualisées) :
- Critères de Mc Donald remplis → SEP
- Mise en évidence de lésions compatibles avec des lésions démyélinisantes sans autre explications (toxiques, iatrogènes, autre patho) → traitement par interféron ou glatiramer
- Absence de lésion compatible avec une lésion démyélinisante → Répéter l'IRM à 3-6 mois :
- Mise en évidence de lésions compatibles avec des lésions démyélinisantes sans autre explications (toxiques, iatrogènes, autre patho) → Traitement par interféron / glatiramer
- Absence de lésion compatible avec une lésion démyélinisante → STOP (pas de traitement, pas d'IRM de contrôle en dehors d'un autre événement clinique suggestif)
Syndrome radiologique isolé compatible avec une SEP (RIS)
= incidentalome = découverte d'une présentation radiologique très évocatrice de SEP sans symptôme en rapport. Critères :
- Lésions de la substance blanche à l'IRM : focales ovoïdes homogènes circonscrites remplissant les critères de Barkhof
- Absence de notion de troubles neurologiques transitoires
- Exclusion de causes toxiques / iatrogènes ou d'une autre pathologie susceptible d'expliquer les anomalies radiologiques
Le risque de développer une SEP est indéterminé. Un suivi radiologique ou un traitement ne sont pas recommandés → réévaluation uniquement en cas de survenue d'un épisode clinique compatible avec une SEP.
Diagnostic différentiel
L'anamnèse, l'examen, le LCR, l'IRM et la biologie doivent permettre d'éliminer :
- Des pathologies infectieuses : rhombencéphalites et myélites virales, tétraparésie spastique tropicale à HTLV-1, maladie de Lyme, SIDA, brucellose, listériose, tuberculose, syphilis,…
- Des pathologies inflammatoires dans le cadre de : sarcoïdose, Behçet, lupus érythémateux disséminé, Sjögren (! Parfois quasi indiscernable avec une SEP → rechercher systématiquement un syndrome sec !), PAN,…
- Des pathologies héréditaires ou dégénératives : atrophie optique de Leber, atrophies cérébelleuses
- Des pathologies vasculaires : angiome médullaire, CADASIL
- Des pathologies tumorales : méningiomes médullaires
- Divers : Chiari, cervicarthrose,…
Prise en charge thérapeutique - Traitements
Symptomatique
- Rééducation
- En chronique ou lors d'une poussée. Evaluer l'opportunité de programmes récurrents de 1-3 mois. Buts : autonomie de la marche, verticalisation, équilibre, prévenir et traiter la spasticité/ troubles vésicosphinctériens, escarres, ergothérapie
- Eviter si possible le travail contre résistance (renforce la spasticité)
- Spasticité (! préserver un certain tonus pour la marche)
- Rééducation, cryothérapie, éliminer les irritations (escarres, infections, constipation,…)
- Antispastiques PO : baclofène (commencer à 5-15 mg jusqu'à maximum 120 mg/ jour, effets secondaires digestifs ++, le plus efficace), dandrolène (surveiller la fonction hépatique), valium, gabapentine, tizanidine,… à instaurer de façon progressive
- Baclofène intrathécal
- Indications : possibilités de marche + spasticité rebelle, grabataires mais spasticité handicapante (contractures, difficultés de mobili)
- Test de différentes doses avec réservoir provisoire → mise en place d'une pompe
- Débuter à 25 µg/ jour jusqu'à dose efficace (max 500 µg/ jour)
- Injections de toxine botulinique en cas de spasticité sévère localisée à peu de muscles → effet 12-16 semaines
- Neurotomie,… dans les cas les plus avancés
- Douleur
- Douleurs ostéo-articulaires → kinésithérapie, rééducation
- Douleurs neurogènes → anti-épileptiques (gabapentine, 1,2-3,6 g/ jour), carbamazépine, clonazépam, valproate) si douleurs paroxystiques (++ névralgie du V/ Lhermitte) ou dysesthésies, tricyclique (clomipramine, amitriptyline 25-150 mg/ jour) et tramadol retard (150-200 mg/ 12 heures) si douleurs continues, morphine PO peu efficace à réserver aux cas résistants.
- Douleurs associées à des spasmes toniques → anti-épileptiques (clonazépam)/ antispastiques
- Douleurs iatrogènes (PL, perfs d'interférons,…) → crèmes locales anesthésiques (Emla)
- Troubles vésico-sphinctériens et sexuels après bilan neuro-urologique
- Hyper-réflexie du détrusor avec mictions impérieuses/ incontinence → restriction hydrique, oxybutinine 5-30 mg/ jour, toltérodine 2 mg/ 12 heures +- autosondages si persistance d'un résidu
- Enurésie → 1-désamino-8-vasopressine spray nasal au soir
- Hypocontractilité vésicale et dyssynergie vésicosphinctérienne avec rétention → horaire mictionnel rigoureux, antispastiques (baclofène, tizanidine) et α-bloquants. Si rétention chronique → auto-sondages
- Constipation → mucilages, lactulose, paraffine suppos
- Troubles érectiles → sildénafil, tadalafil, vardénafil (bilan cardio auparavant !) / vibrateurs, vacuums / injections intracaverneuses de PgE
- Sécheresse vaginale → lubrifiants
- Fatigue
- A prévenir par de l'exercice régulier avec fractionnement des efforts et rééducation. Hygiène de vie. Support psychologique.
- Médication à éviter au maximum et uniquement après avoir éliminé les autres causes de fatigue chronique : amantadine 2x 100 mg/ jour (matin et midi) 3 semaines/ 4 (réduire les échappements thérapeutiques), methylphenidate 2-3x20 mg/ jour, fluoxétine ou autre SSRI,…
- Tremblement
- D'attitude → β-bloquants, primidone
- Cérébelleux → réponse médiocre mais essayer isoniazide (0,8-1,2 g/ jour), clonazépam, β-bloquants, primidone, gluthimide, buspirone,…
- Troubles thymiques et cognitifs
- Psychoth, SSRI, (benzos)
- En cas de rire spasmodique → amitriptyline 25-50 mg, fluvoxamine 100 mg au soir, fluoxétine, l-dopa
- Troubles mnésiques → groupes de soutien, programmes d'entraînement mnésique (pas d'EBM). Les vrai syndromes démentiels sont rares (< 5%) et très tardifs
Des poussées
Indication : poussée avec un déficit objectif invalidant (visuel, moteur, cérébelleux) / sensitives avec douleurs importantes. Les poussées sensitives légères à modérées ne sont habituellement pas traitées. EBM : efficacité similaire des corticos IV / PO ou ACTH (sauf pour névrites optiques où la corticothérapie IV donne de meilleurs résultats que PO).
- Corticothérapie :
- IV : 0,5-1 g/ jour à perfuser en 2-3 heures durant 3-7 jours avec régime pauvre en sel et glucides
- PO : alternative acceptable hors névrites optiques si hospitalisation refusée / impossible. Ex de schéma : 48 mg/ jour durant 7 jour > 24 mg/ jour durant 7 jours > 12 mg/ jour durant 7 jours
- ACTH : 80 mg/ jour IM/SC durant 7 jours puis 40 mg/ jour durant 3 jours puis 20 mg/ jour durant 3 jours – pour patients avec contre-indication aux corticoïdes ou préférant un traitement au domicile
- Plasmaphérèses – pour poussées sévères non améliorées par corticoïdes
Bilan précure : iono, ECG, numération-formule-CRP, EMU, radiographie du throrax. Prévention gastrique, surveiller glycémies.
→ La survenue d'une poussée doit également faire envisager une modification du traitement de fond en consultation.
Les traitements de fond disponibles
Tous les traitements immunomodulateurs ou immunosuppresseurs doivent être interrompus en cas d'infection sévère et deux mois avant une grossesse. De règle, être aggressif pour les patients jeunes en début d'évolution d'une forme rémittente. Attitude plus conservatrice pour les patients > 50 ans, les SEP avancées, les formes progressives.
Toujours mettre en balance le bénéfice discutable de ces traitements (EBM faible, certains traitements n'ont aucun bénéfice démontré, aucun traitement n'a un bénéfice démontré sur le long terme) aux risques iatrogènes.
Interférons β : Avonex/ Rebif (1a), Bétaféron/ Extavia (1b)
Indiqués certainement dans les formes rémittentes le plus précocément possible : diminue le nombre de poussées et le déficit fonctionnel cumulé à moyen terme (rien de démontré sur le long terme). L'efficacité est plus discutable dans les formes progressives mais semble cependant être significative lorsque le traitement est instauré précocément pour les formes ayant un fort caractère inflammatoire (persistance de poussées, évolutivité inflammatoire IRM).
Effets secondaires : syndrome pseudo-grippal (persistant au long cours dans 4%, traitement par AINS), réaction allergiques, exceptionnelles nécroses au site d'injection pour les SC, troubles thymiques mineurs,… Elévation fréquente des enzymes hépatiques mais toxicité majeure ou clinique rare mais éviter les autres drogues hépatotoxiques et l'alcool. Douteux : anémie, leucopénie, polyneuropathies.
Réaliser une biologie (hémato-CRP-iono-fonctions rénales et hépatiques-TSH) 1x/ mois durant les 6 premiers mois. Diminuer les doses de 50% si cytolyse hépatique persistante > 3 x la norme ou leucopénie sans autre cause.
Acétate de glatiramère : copaxone
Aussi efficace que les interférons β sur les formes rémittentes. Très bonne tolérance (effet secondaire : hypersensibilité immédiate d'évolution toujours bénigne, désensibilisation possible), pas de monitoring nécessaire.
Dimethyl fumarate
Aussi efficace que le glatiramère sur les formes rémittentes. Effets secondaires : flushs et troubles gastro-intestinaux mineurs. Lymphopénie possible → Hématogramme 1 x endéans les 6 mois puis 1x/ an.
Teriflunomide
Semble aussi efficace que les interférons et le glatiramère mais moins connu.
Très hépatotoxique → Contre-indication absolue = pathologie hépatique connue, éthylisme. Monitoring par transaminases et bilirubinémie 1x/ mois durant 6 mois puis 1x/ an. Autre Effet secondaire = alopécie
Très tératogène → à éviter chez les femmes en âge de procréer. Tant les hommes que les femmes désirant procréer doivent arrêter le traitement et prendre du charbon activé ou de la cholestyramine durant 11 jours pour accélérer l'élimination, la grossesse restant contre-indiquée tant que la [teriflunomide] > 0,02 mg/ l.
Cyclophosphamide : endoxan
Les traitements par cures sont contestés. Réservé pour les formes résistantes. Inefficacité pour les formes primaires progressives. Principaux effets secondaires : cystites hémorragiques, nausées, vomissements, infections, alopécie, hypogonadisme, fibrose pulmonaire, néoplasie de la vessie (!). Tératogène et contre-indiqué durant l'allaitement. Biologie et EMU à chaque traitement.
Natalizumab : tysabri
Anticorps monoclonal démontré efficace pour les formes rémittentes. Mais : coût faramineux pour un bénéfice à long terme hypothétique, effets secondaires rares mais dramatiques (leuco-encéphalite multifocale progressive - LEMP !) et peu de recul → à réserver aux formes résistantes à tout autre traitement et très actives.
Mitoxantrone
Semble efficace… également approuvé pour les formes progressives… mais… effets secondaires : cardiotoxique !!!, quelques cas de leucémies aiguës, aménorrhée, leucopénies transitoires,… → bilan cardiologique précure puis 1x/ 6 mois, réservé aux formes très sévères avec aggravation rapide du handicap ou poussées avec séquelles rapprochées avec composante inflammatoire confirmée par l'IRM et résistantes aux autres traitements. Dernières données remettent en question son efficacité et suggèrent un taux de complications sévères plus important qu'attendu…
Azathioprine : azathioprine, imuran
Semble avoir une efficacité pour les formes rémittentes. Trop peu d'études récentes cependant… Dose d'entretien habituelle : 1-3 mg/ kg. Nombreux effets secondaires, bien qu'il soit le mieux toléré des immunosuppresseurs : risque significatif de cancers après 10 ans de traitement (→ = durée maximale !), intolérance digestive, leuco/lymphopénie (biologie 1x/ semaine durant 1 mois puis 1x/mois !), thrombopénie, hépatites cholestatiques réversibles à l'arrêt. Prévoir une congélation de sperme et une contraception !
Méthotrexate : ledertrexate
Quelques études encourageantes dans les formes progressives. Bonne tolérance mais risque de cirrhose et pneumopathies interstitielles si traitement au long cours.
Cladribine
Démonstration d'un effet sur les lésions radiologiques des formes progressives, pas sur l'évolution clinique. Coût faramineux. Pas encore assez d'évidence pour les formes rémittentes. A proposer à visée compassionnelle pour les formes progressives primaires ?
Laquinimod
Peu d'EBM. Semble discrètement efficace sur les formes rémitentes.
Daclizumab, rituximab
Anticorps monoclonaux. Pas encore assez d'evidence.
Corticoth, électrophorèses et cures d'Ig
Pas d'evidence. Utilisation fréquente en pratique cependant de bolus mensuels de corticoïdes dans des formes résistantes ou progressives.
Greffes de cellules souches hématopoïétiques et irradiation lymphoïde totale
Ont été démontrées efficaces, prometteur. Mais nombreux effts secondaires, traitement lourd, compromet la mise en route d'autres traitements, peu de recul,… → non recommandé actuellement, du domaine d'études…
Fingolimod (Gilenya)
Utilisé dans les formes rémittentes. Décès rapportés sur troubles cardio-vasculaires et… quelques cas inexpliqués. Si utilisé, bilan précure = hémato + fonction hépatique, sérologie VZV, ECG, examen ophtalmologique et dermatologique (lésions précancéreuses ?). Vaccination VZV 1 mois avant si sérologie négative. 1ère dose sous monitoring durant 6 heures avec électro-cardiogramme (ECG) à la fin. Durant traitement : monitoring infectiologique et hépatique, examen ophtalmologique 1x/ 3 mois.
Contre-indications = infarctus myocardique ou cérébral, angor instable, insuffisance cardiaque les 6 mois précédents, blocs auriculo-ventriculaires (BAV) 2 ou 3, maladie du sinus, QT long, traitements par antiarythmique. NB : pas de donnée concernant le diabète…
Schémas de traitement de fond selon la forme clinique
But d'un traitement de fond : diminuer le nombre de poussées, ralentir l'évolution et limiter le déficit cumulé à moyen terme.
Formes rémittentes
Démonstration EBM de leur efficacité (à moyen terme), principalement en début d'évolution (prédominance des lésion inflammatoires sur les lésions dégénératives) → de principe, commencer aggressivement et le plus précocément possible. Exemple de schéma, à adapter selon profil du patient :
- Traitements de 1ère ligne :
- Acetate de glatiramere 20 mg/ jour SC
- Avonex 30 microg 1x/ semaine IM
- Traitements de 2ème ligne :
- Betaferon 0,25 mg SC 1x/ 2 jours
- Rebif 22-44 microg SC 3x/ semaine
- Fumarate
- Teriflunomide
- Traitements de 3ème ligne pour les formes résistantes et hautement actives (effets secondaires importants ++)
- Rajouter des bolus mensuels de solumedrol 1 g IV
- Combinaison bolus mensuels de solumedrol 1 g IV + suivi le même jour de cyclophosphamide 800 mg/ m2 IV en 30 minutes puis adapter le cyclo selon :
- ! Faire un hématogramme à 10-12 jours → adaptation de la dose suivante : augmenter de 200 mg/ m2 (100 mg/ m2 si dose de 1400 mg/ m2 déjà atteinte) jusqu'à ce que les leucocytes soient entre 1500-2000/ mm3. Dose maximale de 1600 mg/ m2. Diminuer de 100/200 mg/ m2 si leucocytes < 1500/ mm3.
- ! Faire un hémato pré-thérapeutiques : dose programmée si leucocytes > 4000/ mm3, 75% de la dose si leucocytes entre 3000-4000/ mm3, 50% si entre 2000-3000/ mm3, pas de traitement si leucocytes < 2000/mm3
- Fréquence des cures : 1x/ mois durant 1 an > 1x/ 6 semaines durant 1 an > 1x/ 2 mois durant 1 an > 1x/ 3 mois durant 1 an > stop !)
- Administration concommitante d'un anti-émétique.
- Shift vers monothérapie Fingolimod (! 1ère cure sous monitoring < risque de bradycardie sévère) ! série de décès inexpliqués – déconseillé par certains experts !
- Shift vers monothérapie natalizumab 300 mg IV toutes les 4 semaines ! risque de LEMP – peu de recul quant aux risques ! A réserver aux SEP agressives.
- En cas d'échec de tous les autres traitements et d'évolution rapide : envisager mitoxantrone 4-12 mg/ m2 IV 1x/ 3 mois (dose maximale cumulée de 140 mg/ m2) ?, relais par immunomodulateur
Formes secondairement progressives
Peu d'EBM, bénéfice discret démontré à moyen terme → Privilégier abstention. Selon situation, évolution et effets secondaires, discuter :
- Cures mensuelles de solumedrol 1g IV
- +- cures mensuelles de cyclophosphamide
- Methotrexate PO / SC 7,5-20 mg/ semaine. Eventuellement combiné à des cures mensuelles de solumédrol
- Envisager l'adjonction/ le maintien d'un interféron en cas de persistance de poussées surajoutées / (d'une dégradation clinique rapide)
Formes progressives primaires
! Aucune recommandations EBM ! Pas de démonstration d'un bénéfice → à ne proposer qu'au cas par cas, prudence particulière quant aux contre-indications et effets secondaires ! Sont parfois recommandés sur base purement empirique – dans le cadre d'essais ou à visée purement compassionnelle :
- Cures mensuelles de solumedrol 1g IV
- Methotrexate PO / SC 7,5-20 mg/ semaine. Eventuellement combiné à des cures mensuelles de solumédrol
- Cladribine ?
- Mitoxantrone ?
Suivi et évaluation de la réponse thérapeutique
Suivi essentiellement clinique assuré par les médecin traitant, neurologue et spécialiste en médecine physique +- psychologue/ psychiâtre et paramédicaux. Rôle central de la médecine physique-réadaptation et des paramédicaux (ajustements réguliers d'un projet de rééducation).
En cas de "mauvaise réponse clinique" : bilan IRM cérébrale + médullaire pour nouveau base-line avant éventuel shift thérapeutique. Pas d'EBM ni de consensus quant à la définition d'une "mauvaise réponse clinique" (certains considéreront une augmentation de la fréquence des poussées, d'autres une dégradation du DSS, d'autres la simple survenue - inévitable...- d'une poussée).
En cas de stabilité clinique sous traitement : pas d'EBM, pas de consensus. Certains recommandent un bilan radiologique annuel (IRM cérébrale +- médullaire selon les auteurs) et un shift thérapeutique en cas de signes radiologiques isolés d'activité sans aucune EBM pour appuyer cette démarche (+ risque de fibrose systémique néphrogénique sur expositions répétées au gadolinium, ++ si insuffisance rénale). D'autres recommandent un suivi purement clinique à des fréquences variables.